自由摂食動物に比べてカロリー制限(30-40%)動物の寿命が40-50%延長し、がんなどの加齢関連疾患の発症や生体機能の低下が遅くなることは半世紀以上前から知られています。 老化制御研究のための摂取カロリーと老化カロリー制限(食餌制限)動物実験は、ほとんどの場合、離乳期あるいは若齢期から生涯にわたって行われています。数は少ないのですが、中齢期以降の制限でも寿命延長と抗老化作用があるという報告があります。 私たちはカロリー制限が幅広い抗老化作用を持つことから生理的老化の基本的なしくみと深く関係していると考え、ラットおよびマウスを用いて研究を行っています。 前述のように(老化モデル動物)、 ラットおよびマウスの生存率の加齢変化やその他のパラメータの加齢変化から類推して、マウスやラットではヒトの30倍の速さで老化が進行すると考えられます。研究には、ヒトの60歳から65歳くらいに相当すると考えられる24ヶ月齢から26ヶ月齢のラットあるいはマウスを用いることにしました。 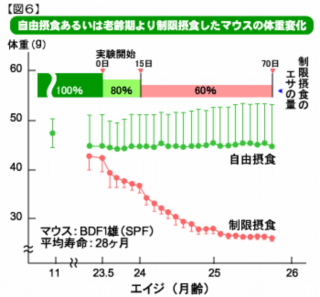 食餌制限によるマウスの体重変化
食餌制限によるマウスの体重変化図6のグラフは自由に食餌(エサ)を摂らせたマウスと老齢期から食餌制限をして飼育したマウスの体重変化です。 食餌制限は23.5ヶ月から開始し初めは自由摂食時の80%、24ヶ月からは60%に制限しました。その結果、一ヶ月後には体重が約40%減少し、その後はほぼ一定になりました。 加齢によって体内で起こっている変化 加齢によって、熱安定性や分子活性が低下した酵素、酸化などの修飾を受けたタンパク質が増加することがわかっています(Takahashi R, Mori N, Goto S: Mech Ageing Dev 33: 67-75, 1985)。このように変化したタンパク質を“異常タンパク質”(→異常たんぱく質の蓄積 異常たんぱく質は何故増えるのか)と呼んでいます。 異常タンパク質は、そのタンパク質の機能低下のためだけでなく、新たに獲得した有害機能のために老化を促進する可能性があります。 このように、体内に若齢期にはなかった異常タンパク質が蓄積し、アルツハイマー病や白内障など様々な病気を引き起こす原因となると考えられています。 私たちは、このような明瞭な病態以外にも加齢による生体機能の低下に異常タンパク質が関わっていると考えています。 では、蓄積した異常タンパク質を排除し、老化の原因のひとつを取り除くことはできるのでしょうか? 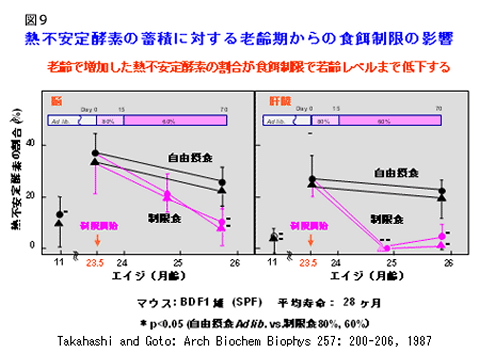 熱不安定酵素の蓄積に対する老齢期からの食餌制限の影響
熱不安定酵素の蓄積に対する老齢期からの食餌制限の影響 私たちは、老齢マウスの組織内に熱不安定酵素が増えることを見出し、この増加が食餌制限によってどのように影響を受けるか調べてみました(図9)。 熱不安定酵素 : 酵素は、一般に高温にさらすと構造が壊れて機能が低下します。老齢動物の組織には、すでに構造が部分的に変化した酵素が存在し、そのような酵素は、少し加熱しただけで機能が無くなってしまいます。このような酵素は熱不安定酵素と呼ばれています。 脳における食餌制限の影響 脳における異常酵素は食餌制限開始2ヶ月後にはほぼ若齢動物のレベルになりました。 肝臓における食餌制限の影響 肝臓での異常酵素の減少は脳よりも顕著で、制限開始後1ヶ月で若齢レベルとなりました。 このことは、食餌制限によって、異常タンパク質の分解・除去が亢進し、タンパク質が“若齢化”し得ることを 示唆しています。 つまり、食餌制限は細胞を若いころの状態にリセットすることができる可能性があると言えます。 酸化傷害-酸化修飾タンパク質-の軽減 近年、加齢に伴って酸化修飾タンパク質が増えることが注目されています(Stadtman and Levine: Ann NY Acad Sci 899: 191,2000) 。 私たちは酸化タンパク質を免疫学的に検出する方法を開発し(Nakamura and Goto: J. Biochem. 119 : 768-774, 1996) 、加齢変化を調べてきました。 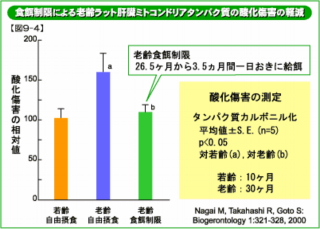 老齢のラットのミトコンドリアタンパク質では、酸化修飾タンパク質の増加が観察されます(右図9−4)。ミトコンドリア (「老化のメカニズム 生体分子に起こる変化 01活性酸素」) は、活性酸素の主な発生源とされていますから、これは予想されることと言えます。
老齢のラットのミトコンドリアタンパク質では、酸化修飾タンパク質の増加が観察されます(右図9−4)。ミトコンドリア (「老化のメカニズム 生体分子に起こる変化 01活性酸素」) は、活性酸素の主な発生源とされていますから、これは予想されることと言えます。 食餌制限の影響 老齢期からのカロリー制限で、ミトコンドリアタンパク質の酸化傷害が若齢レベルにまで減少しました(図9−4)。したがって、食餌制限はミトコンドリアにおける活性酸素の発生を抑え、酸化修飾タンパク質を分解除去する活性を高める作用があると考えられます。あるいは異常化したミトコンドリア全体が除去されて、残った正常なものから新たに形成されてくるのかもしれません。実際、栄養を制限するとミトコンドリアなどの細胞小器官を分解する自己貪食能が高まることが知られています。 このように、加齢で増えたタンパク質の酸化傷害が老齢期からの食餌制限で軽減することが明らかになりました。 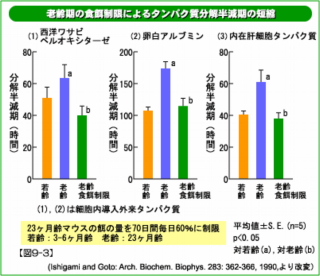 老齢期の食餌制限によるタンパク質分解半減期の短縮
老齢期の食餌制限によるタンパク質分解半減期の短縮 23ヶ月齢マウスのエサの量を60%に制限して70日間飼育し、肝臓細胞を取り出して外来性および内在性タンパク質の分解半減期を調べてみると、老齢期に延長した半減期が制限食群では若齢動物並みに短縮していました。したがって異常タンパク質が蓄積しにくくなっていると考えられます。 食餌制限によるミトコンドリアタンパク質の酸化傷害の軽減 異常タンパク質の分解 (図24−3)にある実験で使ったのと同じラットの肝臓ミトコンドリアのタンパク質について酸化傷害(カルボニル化)の程度を免疫学的に調べました。 ミトコンドリアからの活性酸素の産生は加齢で増加すると報告されていますが、それと一致して高齢ラットのミトコンドリアタンパク質の酸化傷害が増加していました。 この実験では3ヵ月半の食餌制限によって傷害が若齢レベルにまで減少しました。  食餌制限によって活性酸素の産生の減少に加えて傷害タンパク質の分解あるいは傷害ミトコンドリアの除去効率が上昇したと考えられます。
食餌制限によって活性酸素の産生の減少に加えて傷害タンパク質の分解あるいは傷害ミトコンドリアの除去効率が上昇したと考えられます。 細胞内のタンパク質は絶えず分解される一方で、新たに合成されています。成長期では合成が勝ってタンパク質量は増加し、食事(食餌)量の減少や絶食時には分解が勝ってタンパク質量は減少します。健常な成人では増減がなく合成と分解のバランスが保たれています(動的平衡という)。 合成と分解というダイナミックな物質の動きを代謝回転といいます。これは生命に備わった基本的に重要な性質です。細胞内のタンパク質分解反応は一般に一次反応に従うとされています。そのため分解速度ではなく分解半減期でタンパク質の分解されやすさを表します。半減期が短ければ分解されやすく長ければされにくいということになります。細胞内の多くのタンパク質の分解半減期は2日〜5日くらいです。すなわち4〜10日で元のタンパク質は1/4になり、6〜15日くらいで1/8、8〜20日くらいで1/16になるという具合です。半月からひと月もすれば、量の変化がなくても大半のタンパク質分子は別物に置き換わっているというわけです。もっとも一部のタンパク質、コラーゲン、クリスタリン、ヘモグロビンなどのように分解半減期が極めて長いものもあります。 |
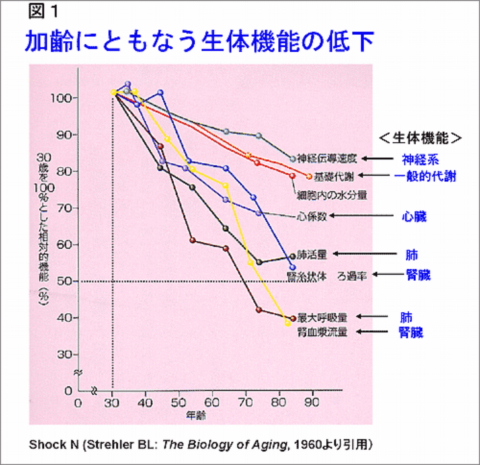
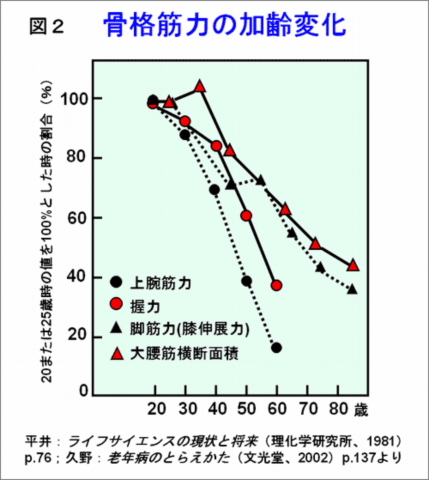
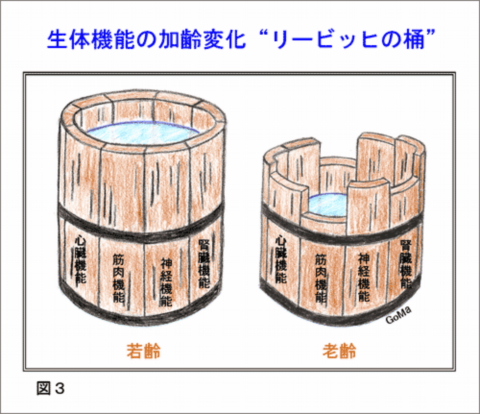
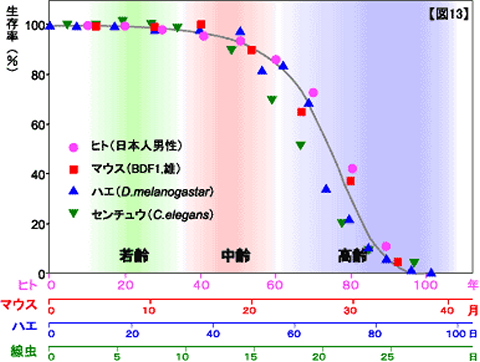 ‘老いとは何か’の二番目の‘老化モデル動物’のなかに右のような図がある。
‘老いとは何か’の二番目の‘老化モデル動物’のなかに右のような図がある。